|
|
 |
Tutorial-3:
Die Struktur von beta-Amyloid:
Wie die Peptid-Oligomeren der Alzheimer-Plaques entstehen
made with
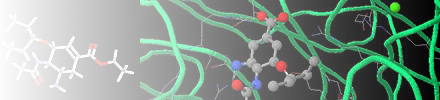
| beta-Amyloid (17-42) (aus:
rcsb.org)
(3.)
|
(1.) Die Struktur besteht aus mehreren seitlich Molekülketten. Die erste Molekülkette wird zunächst dargestellt. Nach Drehung erkennt man den der Molekülkette Es handelt sich um ein Polypeptidkette, die aus 25 Aminosäutreketten besteht und aufgrund eines "loops" nach 10 Aminosäureresten in die Richtung der N-terminalen AS (17) zurückläuft und mit der C-terminalen AS (42) endet. Die Aminosäurereste Valin (36), Methionin (35) und Leucin (34) werden näher betrachtet und durch das "backbone" der Peptidkette eine grüne gelegt, um den hervorzuheben. Um die besondere Konformation des Moleküls und die Bindungsgeometrie erkennen zu können, werden wieder die drei Aminosäurereste Valin (36), Methionin (35) und Leucin (34) und die N-H- und C=O-Bindungen der beteiligten Peptidverknüpfungen markiert. (2.)
|
Kontakt: Dr. Andreas
Brink | TU Dortmund | Fakultät für Chemie und Chemische Biologie
| andreas.brink@tu-dortmund.de